夏宇飞团队Cell Biomat:激活树突状细胞
物质科学
Physical science
近日,中国科学院过程工程研究所夏宇飞研究员团队提出了基于材料界面力学工程的免疫调控新概念—mechano-immunotherapy。通过对铝佐剂进行结构性重设计而非成分替换,形成可调刚度的三维界面,ASPE平台能够在体内建立机械刺激环境并与生化信号协同作用,从而显著提升疫苗免疫反应与DC细胞治疗效果。2025年12月10日,相关研究成果以“Drilling dendritic cell activation: Engineering interfacial mechano-biochemical cues for enhanced immunotherapy”为题,发表在Cell Press细胞出版社Cell Biomaterials期刊上。
文章亮点
建立“动态三维界面”,实现细胞膜机械力的高效传递:团队构建颗粒稳定的Pickering乳液,突破传统二维基底或纳米颗粒结构的限制。该体系可与免疫细胞膜形成高度贴合的接触界面,实现局部机械应力传递。通过调控肌动蛋白-肌球蛋白收缩与膜张力,显著增强PIEZO1力敏通道的激活效率,为机械力驱动的免疫调控提供新策略和新平台。
“老药新用”,将“界面机械刺激”引入临床级铝佐剂体系:研究基于临床广泛使用的铝佐剂,构建了铝稳定Pickering乳液(ASPE),通过调控铝盐晶型与界面刚度,实现对细胞膜接触力场的工程化调控。该策略不改变原有化学成分,仅依托界面力学传递与材料结构调控即可强化免疫激活信号,兼具高临床可转化性与低监管门槛,为传统铝佐剂功能升级提供了普适的新思路。
“机械力-生化信号”双重激活,显著提升疫苗及APDC抑瘤效果:研究揭示ASPE可通过PIEZO1-Ca²⁺-MAPK机械信号轴增强树突状细胞MHC I表达和抗原跨呈递;与MPLA协同递送时,在老年带状疱疹免疫模型中显著提升IFN-γ、IgG2c/IgG1比值及记忆 T 细胞反应。在DC细胞治疗联合PD-1方案中,ASPE平台实现超过2倍的肿瘤抑制效果与生存期延长,展示出强有力的免疫增强潜力与应用前景。
文章简介
在当前免疫治疗和疫苗研发中,增强免疫反应通常依赖TLR、STING等生化通路的激活,但引入新型免疫激动剂往往面临研发成本高、监管严格以及临床转化周期长等瓶颈。同时,传统佐剂与递送材料的优化多集中在粒径、形貌或表面化学等属性,对材料的界面力学性质如何影响免疫细胞功能关注不足。已有研究显示,树突状细胞(DC)在摄取抗原、骨架重排和抗原跨呈递过程中对机械刺激和膜张力变化高度敏感,其中机械敏感离子通道PIEZO1在力学信号向细胞内信号的转化中起关键作用。然而,这些发现主要来自二维基底或人工表面的体外实验,缺乏能够在体内真实微环境中提供可控三维机械刺激的材料系统。因此,基于已获批材料构建一种可在内吞过程中施加可调机械刺激的免疫调控平台,有望突破现有策略的局限。
基于这一问题,本研究从临床成熟、安全性高度确证的铝佐剂(alum)出发,“老药新用”地通过调控铝氧羟化物的晶型,在Pickering乳液界面构建了不同刚度的纳米颗粒排列结构,形成可变形、可调刚度的三维接触界面—Alum-stabilized Pickering emulsion(ASPE)(图1)。与传统颗粒或纳米棒不同,乳滴具备柔性可形变特征,能在细胞接触过程中扩大界面接触面积;而界面颗粒的晶型又决定其刚度,从而可调控乳滴施加的机械刺激强度。这一“可变形乳滴 + 刚度可控颗粒壳层”的组合,使ASPE在体内稳定施加界面机械刺激的佐剂材料体系。本研究系统构建了三类晶型不同的alum稳定的Pickering乳液(图2,ASPE1:无定形;ASPE2:半晶型;ASPE3:高晶型),并通过AFM验证界面刚度随晶型升高而显著增强。尽管乳滴粒径保持一致,而ASPE3的界面铝层因高度结晶化而呈现更高的界面刚度、稳定性和更强的细胞接触驱动能力。
在细胞机制层面,ASPE3在DC内吞过程中产生明显的界面形变并放大接触区,诱导F-actin与Myosin II重组,同时提升膜张力(Flipper-TR成像测定)(图3)。RNA-seq分析进一步显示,ASPE3显著上调机械刺激响应相关基因,包括PIEZO1、多种高电压依赖钙通道以及骨架重塑相关通路。PIEZO1⁻/⁻ DC证实Ca²⁺内流依赖PIEZO1介导,而MAPK/ERK的动态激活则构成了机械信号的主要下游级联。上述多维证据构建了完整的“界面力学刺激 → PIEZO激活 → Ca²⁺内流 → MAPK信号 → DC激活”的作用链条(图4)。
在体内应用中,研究进一步将MPLA(TLR4激动剂)整合入ASPE平台,构建了机械与生化双刺激体系ASPE-M。该平台在带状疱疹gE疫苗模型中表现突出:ASPE3-M诱导显著高于Alum-M的IFN-γ分泌、Th1偏向(IgG2c/IgG1明显提升)以及CD4⁺/CD8⁺记忆T细胞扩增。在老年模型中,ASPE3-M同样维持强效免疫激活,表明该平台在免疫衰老背景下具备可靠的增强性能。
在治疗性应用方面,本研究将ASPE-M用于树突状细胞(DC)细胞治疗。在B16黑色素瘤模型中,ASPE3-M处理的DC显著优于“肿瘤裂解物+分子佐剂”传统方案,表现出更强的肿瘤抑制效果;联合PD-1阻断治疗后,肿瘤生长进一步受控,并显著延长小鼠生存期,表明ASPE-M在细胞治疗领域具有高潜力(图5)。
总而言之,本研究提出了基于材料界面力学工程的免疫调控新概念—mechano-immunotherapy。通过对铝佐剂进行结构性重设计而非成分替换,形成可调刚度的三维界面,ASPE平台能够在体内建立机械刺激环境并与生化信号协同作用,从而显著提升疫苗免疫反应与DC细胞治疗效果。该策略依托临床成熟材料体系,具备良好的可转化性,为新一代佐剂与免疫治疗平台设计提供了重要方向。

图1 “界面力学生化双信号”以强化免疫治疗。为增强树突状细胞(DC)的力学生化协同激活,我们构建了铝稳定 Pickering 乳液(ASPE)。ASPE通过调控铝颗粒晶型形成可调刚度梯度(蓝→粉),向DC膜施加可控机械刺激(①),激活PIEZO1离子通道并触发Ca²⁺内流及其下游信号。同时,ASPE共递送TLR4激动剂MPLA,提供强效生化刺激(②)。两种信号(① + ②)协同驱动DC成熟(提升MHCI、共刺激分子及细胞因子分泌),从而诱导强劲的适应性免疫反应:既可提升疫苗免疫应答,也能增强APDC肿瘤治疗效果。
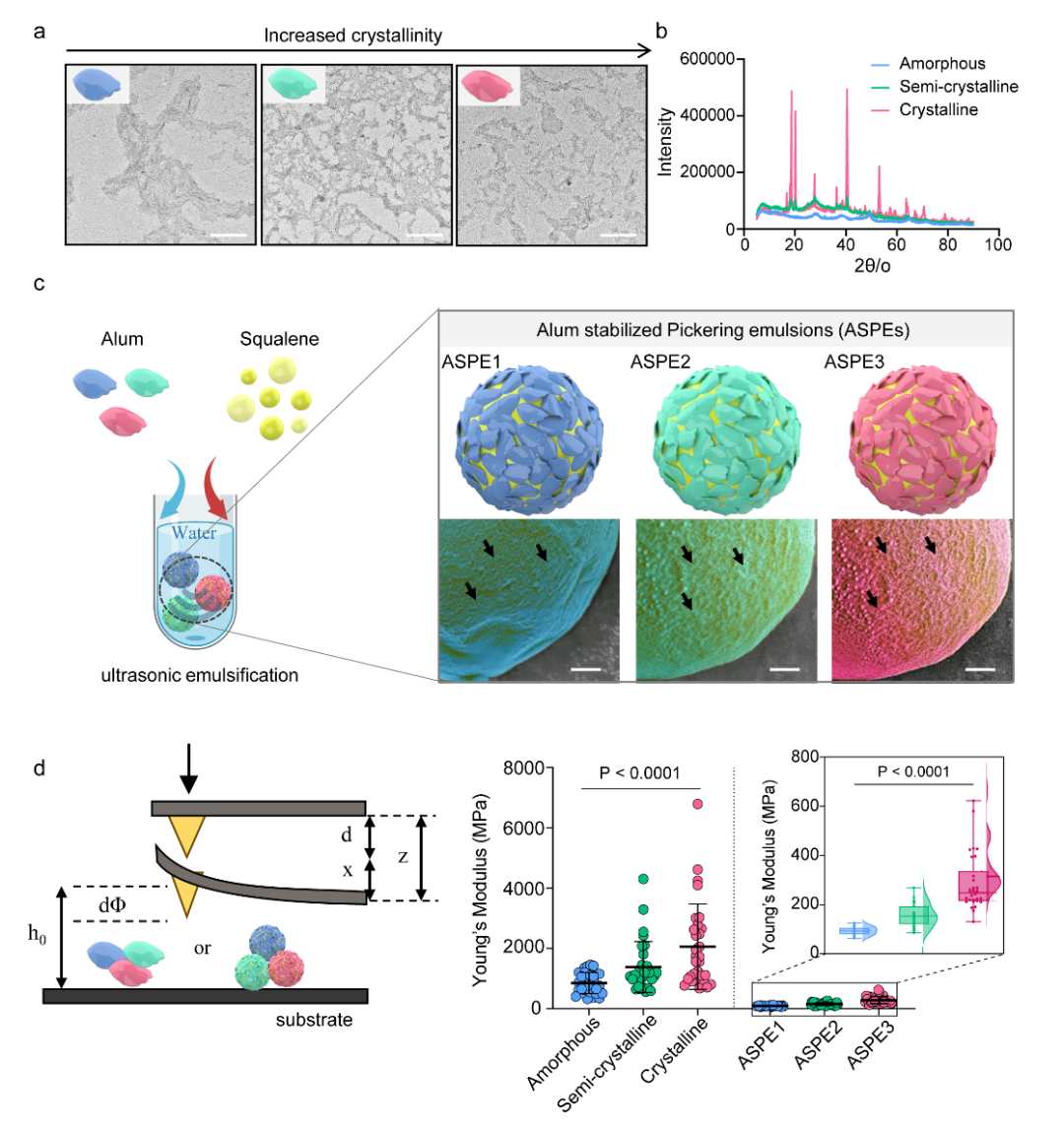
图2 基于晶型调控构建具可调界面力学的铝稳定Pickering乳液(ASPE)。(a) 不同pH(7、9、10)条件下制备的铝颗粒的TEM图像(晶型随pH升高而增强),呈纳米片状结构。比例尺:500 nm。(b) 相应铝颗粒的XRD图谱,分别呈现无定形、半晶型与高晶型特征。(c) 左:ASPE的制备示意图。右:不同晶型铝颗粒在ASPE乳滴界面的SEM图像(ASPE1、ASPE2、ASPE3),黑色箭头标示晶型升高时更加明显的颗粒化界面。比例尺:200 nm。(d) 左:铝颗粒及ASPE的Young’s模量AFM示意图。右:不同晶型颗粒及其对应ASPE(ASPE1–3)的Young’s模量比较(n = 30,3 个独立样本)。晶型提高增强颗粒刚度,而ASPE刚度更低,表明乳滴具更高可变形性。数据以均值 ± s.e.m. 表示,* p <0.05,** p <0.01,*** p <0.001,经单因素方差分析。
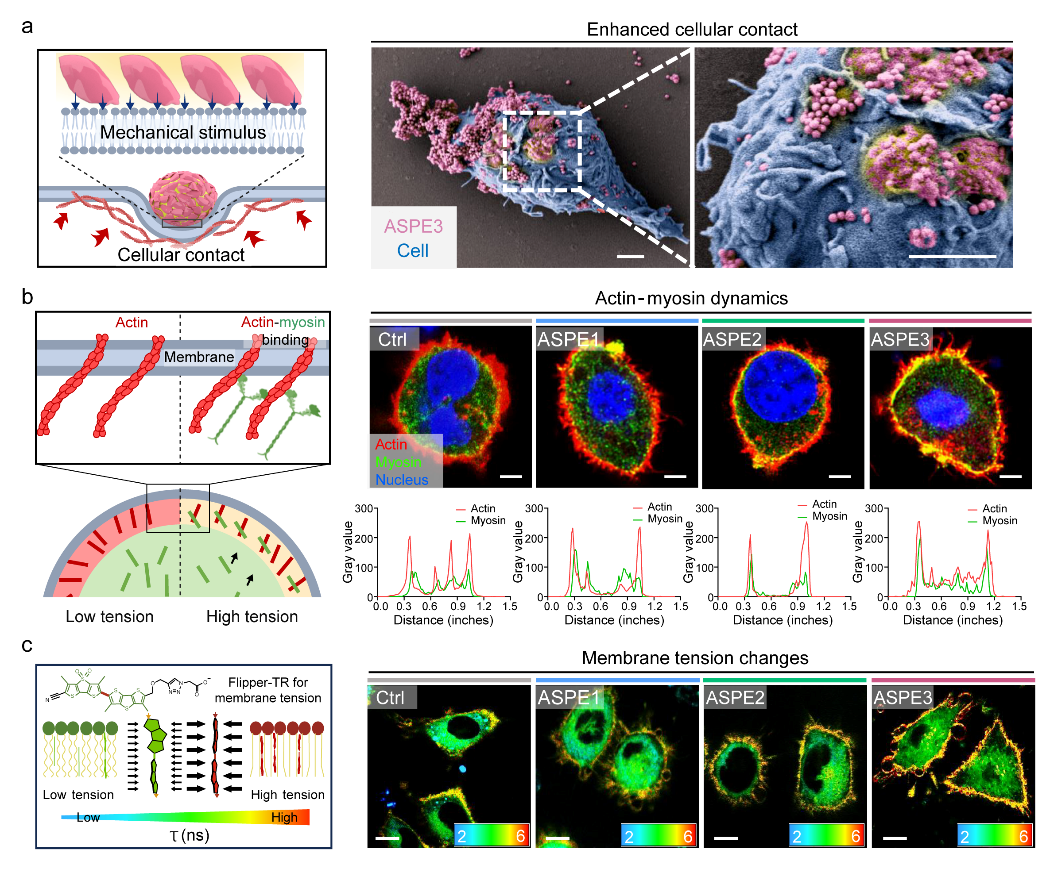
图3 ASPE通过增强膜接触、骨架重排与膜张力提升介导BMDC的力学转导。(a) 左:ASPE3促进细胞-乳滴界面紧密接触的示意图,凸显其触发细胞机械感知的潜力。右:BMDC与ASPE3共孵育4小时后的SEM图像,展示乳滴在细胞表面的变形。比例尺:2 μm。(b) 左:肌球蛋白与肌动蛋白共定位增强促进膜张力提升的示意图。右:共聚焦图像(上)及其荧光强度分布(下),显示ASPE处理后皮质层肌球蛋白(绿)与F-actin(红)共定位增强,提示骨架重排与收缩力生成。比例尺:5 μm。(c) 左:膜颜色、荧光寿命与膜张力关系示意图。右:Flipper-TR荧光寿命成像(FLIM)显示不同晶型ASPE处理后的膜张力变化;ASPE3组膜寿命升高,提示膜张力显著增加。比例尺:10 μm。
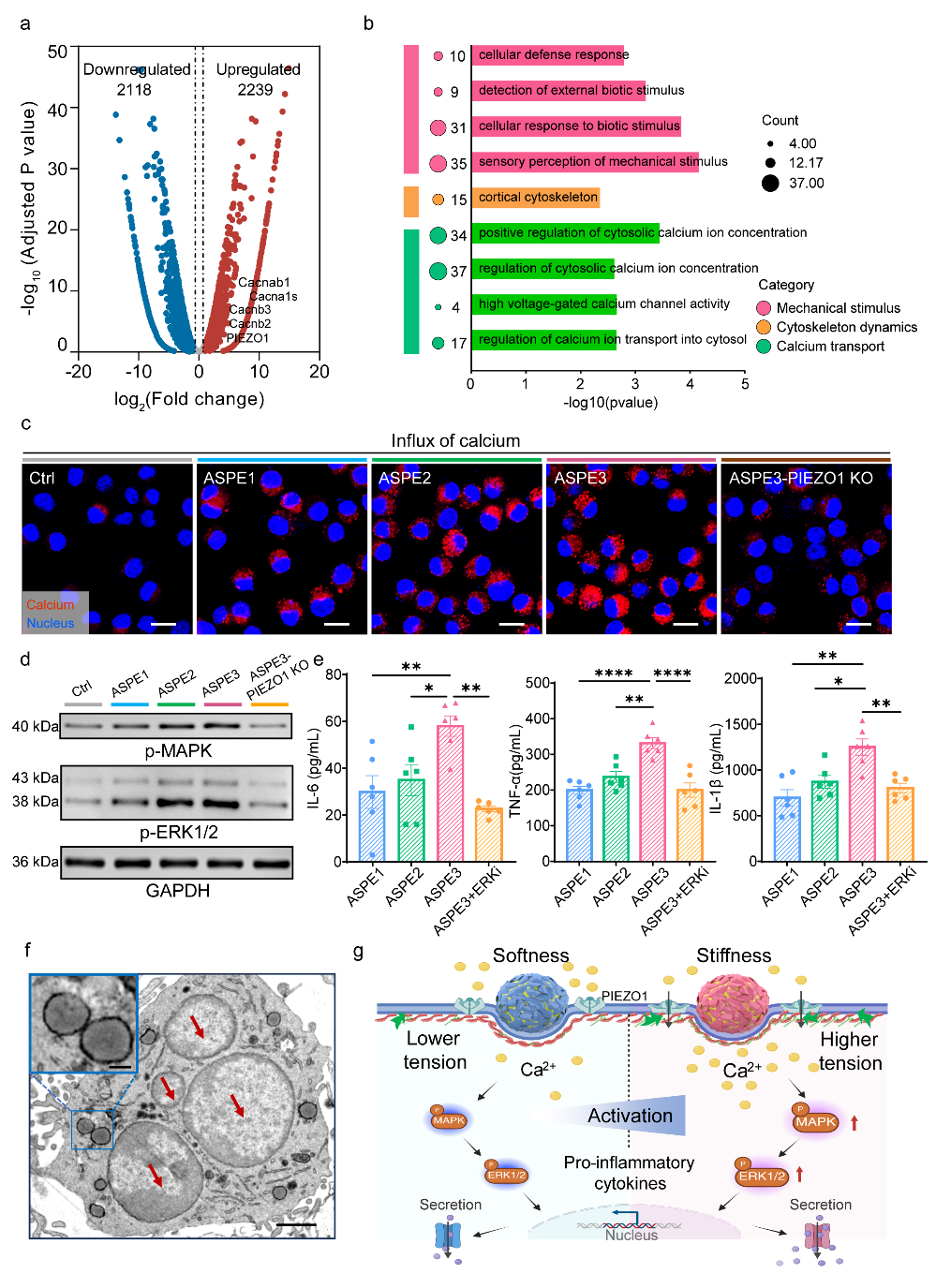
图4 ASPE经PIEZO1-Ca²⁺-MAPK通路对树突状细胞进行机械重编程。(a) 火山图显示高晶型 ASPE3与低晶型ASPE1处理的BMDC差异基因表达情况。ASPE3上调2,118个基因,其中包括机械敏感基因PIEZO1及多种电压依赖性钙通道相关基因(如Cacnb3、Cacna1b、Cacnb2、Cacna1s),提示机械转导与钙信号活性增强。(b) GO富集分析显示ASPE3相较ASPE1处理的BMDC显著富集机械感知相关通路,包括“机械刺激感知”“高电压钙通道活性”与“皮质细胞骨架重组”,支持晶型依赖的机械信号参与DC重编程。(c) 负载Rhod-2 AM的BMDC共聚焦成像显示ASPE3诱导更强的胞内Ca²⁺内流;在PIEZO1⁻/⁻中该效应消失,证明Ca²⁺信号依赖PIEZO1介导的机械敏感通路。比例尺:20 μm。(d) Western blot显示ASPE处理后BMDC中MAPK与ERK1/2的时间序列磷酸化,构成PIEZO1-Ca²⁺-MAPK级联;PIEZO1⁻/⁻ BMDC中该磷酸化缺失,进一步验证通路依赖性。(e) ELISA显示ASPE晶型越高(ASPE1→ASPE3),BMDC分泌的IL-6、TNF-α与IL-1β越显著。ERK抑制剂(ERKi)特异性降低ASPE3诱导的细胞因子水平,证实PIEZO1–ERK轴参与ASPE机械激活(n = 6)。(f) TEM显示ASPE3处理后的BMDC出现多核结构(红箭头),为活化标志。放大图显示乳滴位于细胞质而非内吞溶酶体中(左上角;比例尺:1 μm),支持其促进抗原跨呈递的潜力。比例尺:5 μm。(g) ASPE晶型升高增强BMDC激活的示意图。更高界面刚度触发更强的PIEZO1-Ca²⁺-MAPK力学转导,从而整合机械与生化信号重编程DC功能。数据以均值 ± s.e.m. 表示,* p <0.05,** p <0.01,*** p <0.001,经单因素方差分析。
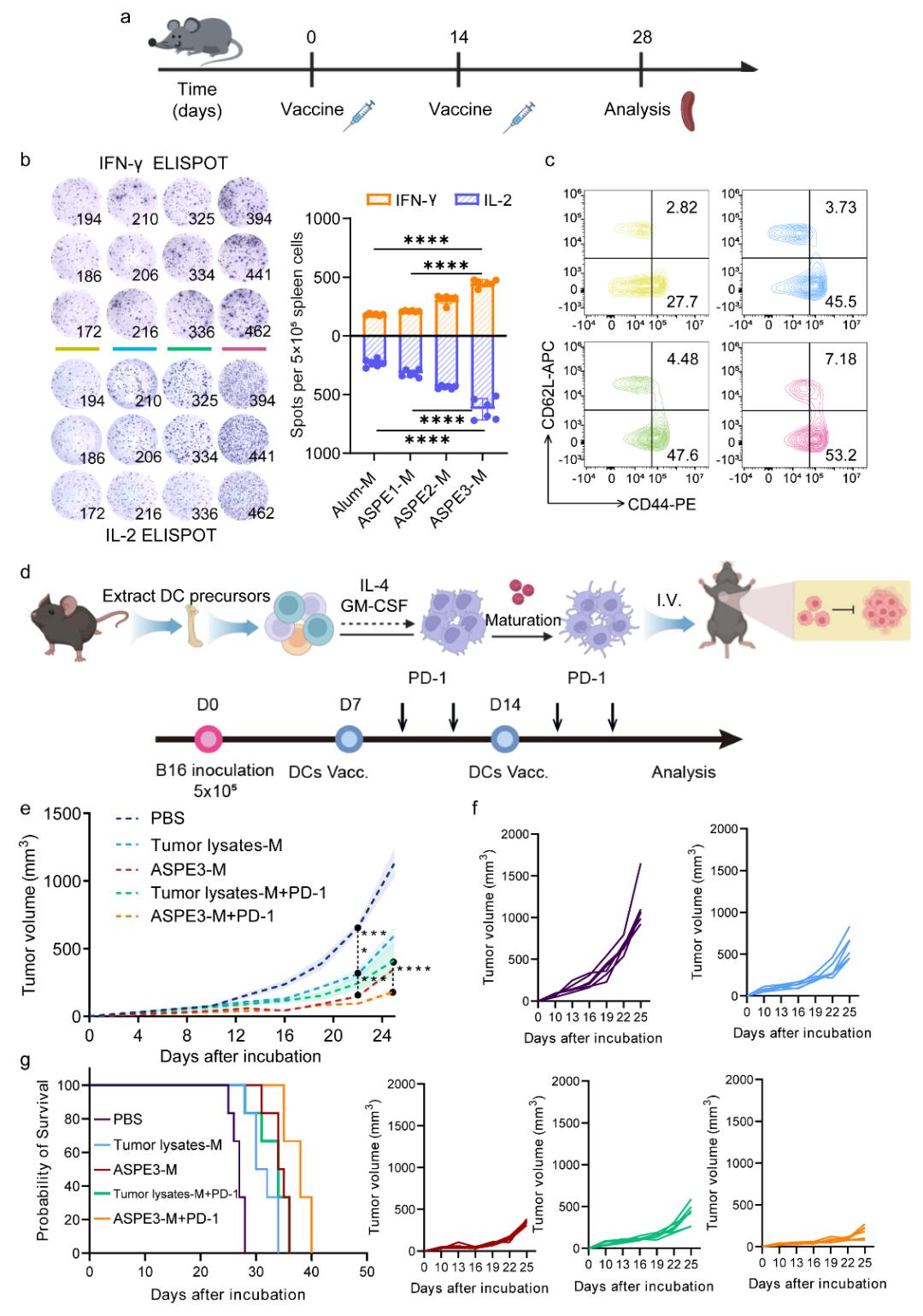
图5 ASPE3与MPLA协同增强VZV疫苗免疫反应及BMDC-肿瘤免疫治疗效果。(a) 免疫流程示意图。14-16月龄C57BL/6小鼠分别在第0和14天肌内注射负载MPLA的Alum、ASPE1-M、ASPE2-M、ASPE3-M),第28天采集脾细胞进行分析。(b) gE抗原再刺激后的ELISPOT结果显示,ASPE3-M组老年小鼠的IFN-γ与IL-2分泌显著高于其他组别(n = 6)。(c) 流式细胞分析显示,ASPE3-M诱导更高比例的CD3⁺CD4⁺效应记忆T细胞(CD44high CD62Llow)和中央记忆T细胞(CD44high CD62Lhigh)。(d) 实验设计示意图:BMDC分别与肿瘤裂解物-M或ASPE3-M进行脉冲处理后静脉注射至B16肿瘤小鼠体内,并联合抗PD-1抑制剂进行联合治疗(n = 9,其中6只用于长期监测,3只用于免疫分析)。(e-g) 肿瘤生长曲线与生存分析显示,ASPE3-M尤其在联合PD-1阻断时显著增强肿瘤控制并延长生存期(n = 6)。数据以均值 ± s.e.m. 表示,* p <0.05,** p <0.01,*** p <0.001,单因素方差分析。
作者专访
Cell Press细胞出版社特别邀请夏宇飞研究员代表论文作者团队进行了专访,为大家进一步详细解读。
CellPress:
请简要概述这项工作的亮点。
夏宇飞研究员:
本研究最大的创新在于提出“界面机械刺激”作为调控树突状细胞的一种全新方式,以实现铝佐剂免疫增效的“老药新用”。我们发现,通过调控铝佐剂的晶型,使其在乳液界面形成具有可控刚度的纳米结构,即可在细胞内吞过程中产生机械应力,激活PIEZO1并增强抗原跨呈递。更重要的是,这种策略不需要引入新的分子实体,具有显著的临床转化潜力。
CellPress:
研究过程中遇到了哪些困难?团队是如何克服并顺利解决的?
夏宇飞研究员:
主要难点是区分“机械刺激”与“其他变量”在免疫激活中的贡献。我们通过AFM、Flipper-TR膜张力成像、骨架重排观察、PIEZO1⁻/⁻细胞、ERK抑制剂实验等手段,建立了机械刺激到信号通路再到功能输出的完整因果链,同时结合RNA-seq进一步验证机械通路的系统性激活。
CellPress:
团队下一步的研究计划是怎样的?
夏宇飞研究员:
我们将继续探索PIEZO1与TLR4在膜域上的空间协同机制,甚至进一步探索机械刺激免疫细胞对细胞代谢产生的影响等。同时我们会继续推动ASPE的生产工艺、CMC与安全性评估,并将“机械力刺激免疫激活”理念扩展至mRNA、蛋白疫苗及多抗原肿瘤疫苗的递送体系的开发指导上,进一步推进其临床可转化性。
CellPress:
最后,是否可以与我们分享一下选择Cell Biomaterials来发表这个工作的原因?
夏宇飞研究员:
Cell Biomaterials聚焦于材料科学与生物医学交叉领域,非常契合我们“通过界面机械工程改变免疫响应”的研究主题。同时,该期刊对于创新机制与转化潜力的强调也与我们的研究高度一致。因此,我们相信这是传播这项工作的最佳平台,也期待Cell Biomaterials可以继续成为本领域Cell Press旗下的flagship!

作者简介

夏宇飞
研究员
中国科学院过程工程研究所研究员,生物材料与生物剂型研究部副主任。以第一/通讯作者在Nature Materials、Advanced Materials等发表SCI论文,获得北京市科技新星、青年颗粒奖以及国际疫苗协会等多项奖励。课题组聚焦疫苗黏膜佐剂、肿瘤疫苗、mRNA递送系统及其组装和递送微观过程研究。
欢迎有志科研之士申请博士后及科研助理职位。按照中国科学院过程工程研究所相关规定执行,提供具有国际竞争力的待遇条件,优秀者推荐申请“特别研究助理”计划,具体待遇面议。申请者请将个人简历投递yfxia@ipe.ac.cn。本招聘长期有效。导师信息及相关个人页面:https://people.ucas.edu.cn/~yufeixia

明亚莉
博士研究生
中国科学院过程工程研究所博士研究生,长期围绕材料–生物界面过程开展研究,聚焦Pickering乳液、纳米腔结构、铝基纳米材料等体系在免疫递送中的作用机制。通过调控界面晶型、刚度、纳米结构与跨膜动力学,系统揭示了材料界面如何影响树突状细胞机械感知、膜张力调节、脂质转移与抗原内吞。构建了“佐剂-细胞膜脂质转移/界面力学刺激驱动免疫激活”等研究体系,并成功将其应用于疫苗佐剂优化、树突状细胞治疗和肿瘤免疫增强等场景。
相关文章信息
研究成果发表于Cell Press
旗下期刊Cell Biomaterials
▌论文标题:
Drilling dendritic cell activation: Engineering interfacial mechano-biochemical cues for enhanced immunotherapy
▌论文网址:
https://www.sciencedirect.com/science/article/pii/S3050562325002727
▌DOI:
https://doi.org/10.1016/j.celbio.2025.100281
原标题:《夏宇飞团队Cell Biomat:激活树突状细胞!材料界面力学工程助力增强免疫治疗 | Cell Press对话科学家》
阅读原文
相关文章:
同济大学余飞教授团队 :自焚核药靶控亚细胞尺度“阿尔法辐射免疫疗法”
鸿蒙生态生产力爆发:千问、夸克、UC 浏览器同步重磅升级,重塑超强生产力
幼童把纸尿裤扔锅里:海底捞报警
盘点 2026 远程控制软件王牌?六强横评,哪款才是实至名归远控王?
远程调试 高效协作 降本增效 —— 索尼发布“电影感直播远程调试”服务工具
一加Turbo 6首销:165Hz屏+9000mAh同档唯一 2099元起
3 亿车主的全场景用车新选择!易捷加油 App 鸿蒙版正式上架
引领营销智能化变革:因赛集团发布智眸 AI2.0,定义达人营销 AI 中台新标准
GEO 服务商如何选择?2026 年 1 月权威推荐榜单发布
新年有小艺,“艺”马当先接鸿运